EPAやDHAを1日10g以上摂取すると出血時間が延びます。また、中性脂肪が高い、高血圧、糖尿病をお持ちの方は、魚油やEPAやDHAを含むカプセルを飲んでいると、LDL-コレステロールが上がる可能性があります。もっとも酸化されやすいDHAは、神経や心筋細胞など、細胞を再生することができない「一生もの」の細胞に多く含まれ、過酸化脂質になりにくく、できた過酸化脂質は速やかに体外に排出される仕組みがあります。

過酸化脂質のことを知るようになって、いろいろな本を探してひっくり返すようになりました。リノール酸が過酸化するとできるHNE(4-ヒドロキシノネナール)は、ずいぶん昔から、アルデヒドの毒物として有名だったようです。現在は、リノール酸をとり過ぎないようにといわれるようになりました。
では、オメガ3のα-リノレン酸や、EPA、DHAはとり過ぎても害はないのでしょうか?実際、EPA、DHAサプリメントは魚油が原料で傷みやすいためカプセル入りになっています。この記事では、オメガ3の脂肪酸のとり過ぎについて調べてみます。
オメガ3系脂肪酸を摂りすぎると出る影響
n-3系多価不飽和脂肪酸の摂取基準の考え方を読むと、オメガ3系脂肪酸を摂りすぎた時の影響について書かれていました。
出血時間の延長
EPAやDHAを1日10g以上摂取すると、「すべての報告で」30~80%出血時間が延びるというのは見過ごせないですね。脳出血が起こりやすくなる可能性があるようです。
1日10g以下では、影響は個人差があり、はっきりしないようです。
魚油,EPAやDHAを含むカプセルを投与し,出血時間を測定した13の報告のなかで,出血時間の延長が認められた報告が九つ,認められなかった報告が四つあった。
EPAやDHA,10g/day以上の投与ではすべての報告で,30-80%出血時間が延長していた。
しかし,10g/day以下の投与量では,関連は明らかでなく,2-3g/dayのEPAやDHA投与でも出血時間が30-50%延長するという報告もあれば,5-7g/dayのEPAやDHAを6カ月,または1年間投与しても,出血時間の延長は認められていないとする報告もある。
高脂血症患者で,鼻出血が認められたという報告は一つあるが,重篤な出血の報告はない。
このように,EPAやDHAを多く摂取し,出血時間が延長しても,臨床上問題を生じた報告はないが,脳出血等の罹患率が増加する可能性は否定できていない。
特定の症状を持っているとLDLコレステロ―ルが増加する
LDLコレステロールは、いわゆる「悪玉コレステロール」のことです。中性脂肪が高い、高中性脂肪血症の患者、高血圧症、糖尿病の患者に限って、LDLコレステロールが増加するようです。
EPAは「血液サラサラ」作用があると知られていますが、サプリメントをお使いの方で、該当する方は、注意する必要があるかもしれません。
高中性脂肪血症患者,高血圧症患者,糖尿病患者で,魚油やEPAやDHAを含むカプセルを投与により血中LDL-コレステロール値の10-30%の増加が認められている。
少ない投与量でもLDL-コレステロールの増加が認められて,たとえば,高コレステロール患者31人に1.7g/dayのEPAとDHAを含むカプセルを投与したところ,1カ月間に16%のLDL-コレステロールの増加が認められている。
しかし,正常人では,LDL-コレステロール値の増加報告はない。また,前記のように,魚油やEPAやDHA投与により,虚血性心疾患罹患率が増加した報告はなく,減少を示す報告がほとんどである。
過酸化脂質の増加は、はっきりしない
オメガ3(n-3系脂肪酸)脂肪酸は、炭素の二重結合が多く、α-リノレン酸で3個、EPAで4個、DHAで5個あります。この二重結合部分が酸化されやすく、オメガ3の脂肪酸が多い油をとっていると過酸化脂質がたくさんできてしまうのではないかと考えられます。
しかし、この論文では、少人数の実験では過酸化脂質が増えた一方で、もっと大人数を対象にした実験では、はっきりしないと書かれています。
n-3系脂肪酸は酸化されやすいため,過剰摂取により人体に害のある過酸化脂質の増加が想定される。
しかしながら,ヒトでの研究は少ない。3報告中2報告で,EPAやDHAの3.0g/day投与により,過酸化脂質(血中TBARS,尿中MDA)の生成が40-50%増加した。
しかし,これらはそれぞれ,23人,7人の少数例の検討であり,260人を対象とした大規模研究ではn-3系脂肪酸摂取量と血中TBA値との間に有意な関係は認められていない。
しかし、過酸化脂質が増えるのかどうかは、いまのように油の摂取量が増えている時代、特に知りたいことです。この論文は2005年に書かれたものですが、それより後に書かれた論文がないか調べてみました。
すると、2008年に書かれた、n-3系高度不飽和脂肪酸摂取時の生体における脂質過酸化に関する研究という論文が見つかりました。
この論文は、平成19年度日本栄養・食糧学会賞受賞したものだそうです。
DHAは体内では過酸化脂質になりにくくできたものも排泄される仕組みがある
オメガ3の脂肪酸の中で最も酸化されやすいDHAについて、入って来るDHAが増えるにつれ過酸化脂質は増えるものの、増やさないような仕組みと解毒して外に出す仕組みがあるそうです。
要旨にわかりやすく書いてありました。
ドコサヘキサエン酸(DHA)に代表されるn-3系高度不飽和脂肪酸は,特有な生理効果が明らかとなっているが,化学構造上きわめて酸化しやすく,多量摂取した際の生体内での過酸化が懸念される。
われわれは,「健常な生体内では,高度不飽和脂肪酸に対する巧妙な過酸化脂質の生成抑制と解毒・排泄機序が存在するために過酸化脂質の蓄積が抑制される」との仮説を立て,最も不飽和度の高いDHA に着目し,ラットをモデル動物として研究を開始した。
その結果,組織過酸化脂質(LPO)はDHA 投与量依存的に増加するが一定レベル以上の投与ではプラトーになる,過酸化されやすさの指標Peroxidizability Index から計算されるほどには増加しない,多量投与でもリポフシン(lipofuscin)のような脂質過酸化終末産物の生成がみられない,かつ,組織細胞傷害も認められない,こと等を観察した。
研究のきっかけがとても興味深いので書いておきます。私たちのような専門外の人間が理解する時に助けになります。
なぜ一度死ぬと再生できない細胞にもっとも酸化しやすいDHAが多いのか?
DHA は,生体内では脳や網膜等の神経組織,心筋,ヒトでは精子等に多く含まれるが,神経や心筋細胞は,いったん傷害を受け細胞死が起きると細胞を再生することができないことから,素朴な疑問として,最も酸化しやすいDHA が何故このような性質をもつ組織に多く含まれるのかということは過酸化脂質・フリーラジカルを研究する著者に取って不可解な現象であった。
事実,脳や網膜のような神経組織では,DHA を多量投与してもほとんどLPOの生成は増加しなかった。
そこで,われわれは,「健常な生体内では,高度不飽和脂肪酸に対する巧妙な過酸化脂質の生成抑制と解毒・排泄機序が存在するために過酸化脂質の蓄積が抑制される」との仮説を立て,(後略)
LPOは、過酸化脂質(Lipid peroxidation)のことです。
最も酸化されやすいDHAが、死んだら再生できない細胞に多く含まれていることは覚えておきたいです。一生ものの細胞に、一番酸化されやすい脂肪酸が使われているのは、考えてみると、とても危険なことです。
しかし、体がそのような選択をしているのですから、著者は、何かDHAを過酸化させにくい仕組みがあるのだろうと考えたのです。
この論文で発見されたことはいくつもあるのですが、私が知っておきたい、抗酸化ビタミンであるビタミンEとビタミンCの仕組みと、PUFA(プーファ:多価飽和脂肪酸)の過酸化でできてくるアルデヒドがどのように解毒排泄されるのかについて書いていきます。
ビタミンEが必要
論文中にはグラフ(Figure2)が載せられており、リノール酸(オメガ6)、α-リノレン酸、EPA、DHAについて過酸化物ができる程度が説明されていました。
それぞれ炭素の二重結合数は、リノール酸が2個、α-リノレン酸が3個、EPAが4個、DHAが5個あります。
二重結合数が多いほど、過酸化脂質ができやすいことは間違いないのですが、過酸化されやすさの指標Peroxidizability Index (以下、P-Index)から計算される数値と比較すると、リノール酸とα-リノレン酸は、ほぼ、P-Indexの数値に従いますが、EPAとDHAは確かにP-Indexをかなり下回っていました。
ただし、これはビタミンE(VE)が存在することが条件です。
通常レベルのVE が摂取されている状態では,DHA 多量投与でもリポフシンや水溶性蛍光物のような脂質過酸化終末産物の生成がみられず,かつ,組織実質細胞傷害も認められない。
しかし,VE欠乏では,脂質過酸化終末産物の生成が増加し,また,脂質過酸化に起因する脂肪組織の黄化現象が起きる。
わからない用語がでてきますが、大まかに脂質過酸化終末産物であると理解します。また、脂肪組織が過酸化すると黄化現象が起きるというのは、感覚的にわかります。
そして、大切なことは、ビタミンEをとることが必要なんだなと思うことです。ビタミンEについて、別記事を書いています。

サプリメントに頼らず、煎茶を飲んだり、アーモンドを食べていればよいと思います。
また、ビタミンEと抗酸化性という記事には、わかりやすい図が出ていたので、真似して描きました。
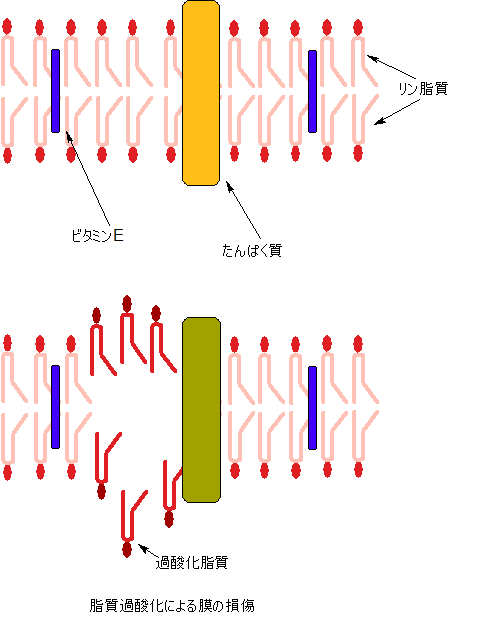
ビタミンEは大量に摂っても意味がない
ビタミンEが入ったサプリメントをたくさん飲んでも意味がないようです。念のため。「通常レベル」でよいのです。
VE を多量摂取したときにDHA 投与により増加するLPOの生成が抑制されるかどうかについて検討した。
その結果,多量摂取によっても組織LPOは通常レベルのVEを摂取したときのLPOレベルよりは低下せず,VEによる抗酸化能には限界があることが明らかとなった。
ビタミンCとグルタチオンも必要である
ビタミンCは、アスコルビン酸のことです。AsAと書かれています。また、グルタチオンは、GSHと書かれています。
DHA をラットに投与すると,特に肝臓では,DHA の投与量が多くなるほどAsA およびGSH のレベルが増加した。
DHAの投与によりLPO生成が高まり,これに対する抗酸化性発現の過程でVE の分解も高まるので,代償的にAsA およびGSH の生成を高めることでVE の抗酸化性を高めていることを示唆している。
ラットにDHAを与える量が増えると、肝臓ではビタミンCとグルタチオンの量が増えるのです。「なぜビタミンCが増えるのか?」と思った方、注意力がある方だと思います。
ヒトはビタミンCを合成できない
ラットはビタミンCを合成できるのです。
ところが、ヒトはできません。ヒトやサルなど霊長類はビタミンCを合成できないのです。しかし、ほとんどの動物はビタミンCを合成できます。これ、意外と知られていません。私も、もちろん知りませんでした。
別な記事ですがビタミンCを合成できない動物は少ないを見てください。
また、ビタミンEとビタミンCの抗酸化作用については、活性酸素について調べてみたに詳しく書きました。

グルタチオン
グルタチオンはこんな構造の物質です。構造式を書いておきます。
グルタチオンの説明は、ウイキペディアにありました。
グルタチオン(Glutathione, GSH, Glutathione-SH)は、3つのアミノ酸(グルタミン酸、システイン、グリシン)から成るトリペプチドである。(中略)
抗酸化物質の1つであるグルタチオンは、フリーラジカルや過酸化物といった活性酸素種から細胞を保護する補助的役割を有する。
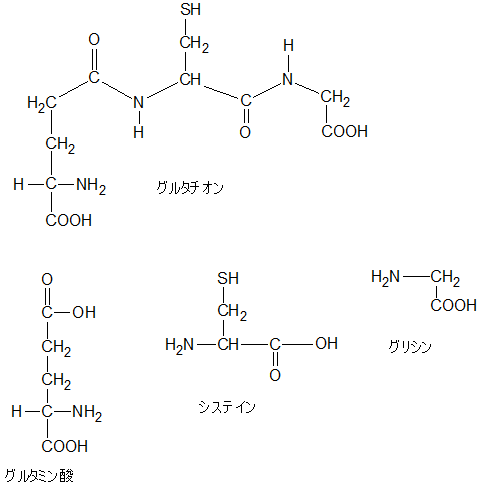
見比べてみると、3つのアミノ酸からできているんだなとわかります。
ビタミンCとグルタチオンを大量に摂ってもやはり意味がない
ビタミンEと同じようにビタミンCとグルタチオンを通常レベルより増やしても過酸化脂質が明らかに減ることはないようです。
AsA を多量投与したときおよびメチオニンを多量投与することで組織のGSH レベルを増加させたときのLPO生成の変化について検討した。(中略)
通常レベル以上のAsA を投与してもさらにVE の還元再生が高まることはなかった。GSH についても同様の検討を行ったが,AsA 投与の場合と全く同様の結果であった。
過酸化してできるアルデヒドを外に出す仕組み
有害なアルデヒドについては、尿から体外に出す仕組みがありました。
脂質過酸化が進むと,生成したLPOの一部は分解し,有害な種々のアルデヒド化合物を生じる。
これらアルデヒド類の一部は,GST の作用によりGSH と抱合体を作り,腎臓に転送された後に代謝を受けてメルカプツール酸(アセチルシステイン抱合体)として尿中へ排泄される解毒・排泄経路が報告されている。
GSTは、グルタチオンS-トランスフェラーゼの略であり、酵素です。グルタチオンGSHはGSTの力を借りて、アルデヒドを抱合する仕組みがあります。
抱合って?
抱合って何だろう?前にも調べた記憶がありますが、ネットで探しました。これがわかりやすい。とりあえず、解毒排泄するため、水に溶けるようにする反応だと覚えておきます。
油溶性成分,毒物,薬物などの解毒排泄機構に利用される反応。
水酸基には硫酸,グルクロン酸,カルボキシル基には,グリシン,グルタミンおよびグルクロン酸,アミノ基に対してはアセチル基およびグルクロン酸が結合し,水溶性になる。(中略)
それぞれ転移酵素によって結合される。抱合の場所は肝臓が主であるが,腎臓でもわずかながら行われる。(出典)
イラストレイテッド ハーパー・生化学 原書29版にはこのように書かれていました。

通常,グルタチオンはGSHと略記される.SHはシステインのスルフヒドリル基(注:チオール基ともいう)のことで,ここが中心的な役割を果たすので,このように表されるわけである.
たとえばある種の発がん物質のような,潜在的毒性をもった多くの求電子性生体異物は,求核物質であるGSHと,次に示すような反応によって抱合される.
ここで,Rは求電子性生体異物を表す.この反応を触媒する酵素は,グルタチオンS-トランスフェラーゼと呼ばれ,肝臓の細胞質には豊富に存在するが,ほかの組織では少ない.
ヒトの組織には,さまざまな種類のグルタチオンS-トランスフェラーゼがある.(中略)
もしも潜在的毒性をもった化合物がGSHに抱合されないとすると,DNA,RNA,または細胞内たんぱく質と結合してしまい,重大な細胞障害が生じることになる.すなわち,GSHはある種の薬物や発がん物質のような毒性をもった化合物に対する重要な防御機構であるといえる.(中略)
GSHを構成しているグルタミン酸部分とグリシン部分が,それぞれ特異的な酵素で取り除かれ、アセチル-CoAに由来するアセチル基が,残っているシステインのアミノ基に付加される.
この結果生じた化合物は,L-アセチルシステインが抱合した形のメルカプト酸 (注:メルカプツール酸)mercapturic acidであり,これが尿中に排泄されるのである.
求電子性と求核物質については、調べ始めるとすぐにかなり時間がかかることがわかったので、ここでは触れません。
抱合反応にかかわる、解毒される物質が求電子性という性質を持ち、GSHは求核物質であると思って先に進みます。
抱合反応の実際
さて、実際にどんな反応をするのか、知りたいところです。念入りに調べていくと、α,β-不飽和アルデヒドの代謝と毒性という論文に書かれていました。
α,β一不飽和アルデヒドは, β炭素の高い求電子性のためにpH7.4の生理的条件下,非酵素的にGSHのSH基と反応する.また,この反応はGSTの共存下では顕著に促進される.
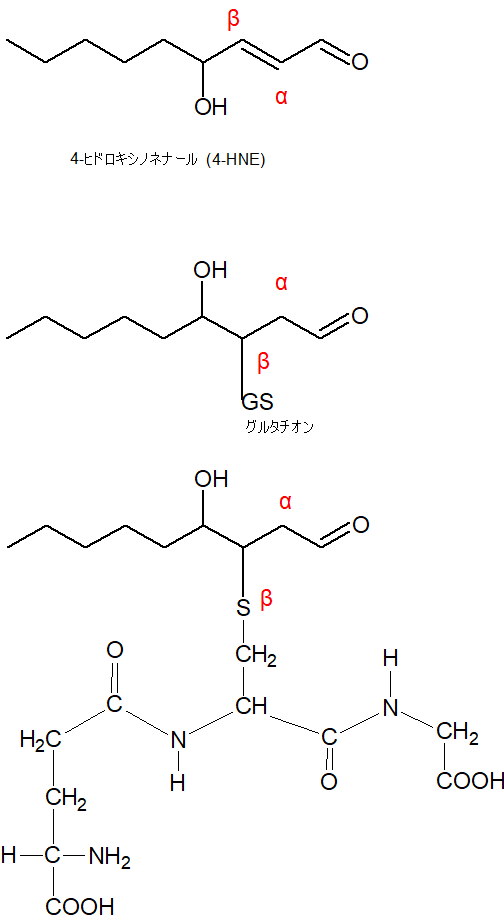
α炭素、β炭素は下図を見てください。α炭素(アルファたんそ)は、官能基と隣接した1番目の炭素のことを指します。(出典)
この場合の官能基は、一番右端のアルデヒド基(-CHO)です。
α,β一不飽和アルデヒドの一例として出て来たのは、DHAではなく、リノール酸からできる過酸化物としてよく知られた4-ヒドロキシノネナール(4-HNE)です。
私もそれに従って、4-ヒドロキシノネナール(4-HNE)を使って図を描いていきます。
β炭素にグルタチオン(GSH)が結合
普段は、下図一番上のように書いていますが、β炭素と結合させるために、上下を反対にして、グルタチオン(GSH)をつけました。位置を確認してください。
さらにその下に、グルタチオンの構造式を実際に結合させた図を書きました。ほとんど自分の理解のためなのです。
結合したものは、グルタチオン抱合体と呼ばれます。
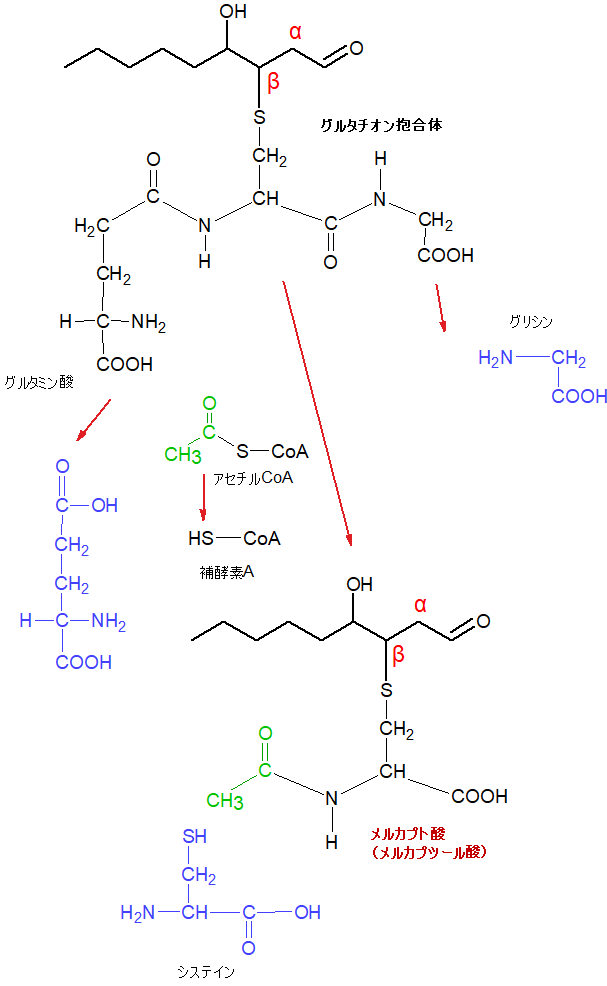
さらに、この状態から、尿から排泄されるようにメルカプト酸 (メルカプツール酸)に変わります。
この時に起きる変化は、上で書いた通り。
グルタチオン抱合体からメルカプト酸 (メルカプツール酸)へ
グルタチオン抱合体のグルタチオンからグルタミン酸とグリシンが抜け、システインだけが残ります。
さらにアセチルCoAから、アセチル基を受け取り、メルカプト酸 (メルカプツール酸)ができあがります。メルカプト酸は、アセチルシステイン抱合体とも呼ばれます。
これが尿から排出されます。こうして、体に不要で有害な4-ヒドロキシノネナールは体外に出ていきます。
オメガ3、DHAの過酸化脂質は4-HHE(4-ヒドロキシヘキサナール)
では、DHAの場合は、どんな過酸化脂質を作るのだろうと思ったら、4-HHE(4-ヒドロキシヘキサナール)というものでした。
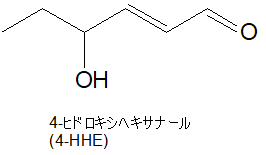
4HNE(4-ヒドロキシノネナール)は炭素数が9個でしたが、こちらは、「ヘキサ」なので炭素数が6個です。
4-HHE(4-ヒドロキシヘキサナール)のグルタチオンとの反応は、4HNE(4-ヒドロキシノネナール)と同じです。上の図で、置き換えて考えていただければよいと思います。
グルタチオン抱合体をつくり、さらにメルカプト酸 (メルカプツール酸)へと変化して、尿から体外へ排泄されます。
NOTE
健康によいといわれるオメガ3の脂肪酸ですが、EPAやDHAを1日10g以上摂取すると、出血時間が長くなる、つまり、血が止まりにくくなるそうです。
また、中性脂肪が高く治療を受けている人、高血圧症、糖尿病の患者に限って、LDLコレステロールが増加することが知られています。
EPAやDHAは魚の脂肪に豊富に含まれています。オメガ3とオメガ6の脂肪酸、いわゆるPUFA(多価不飽和脂肪酸)の過酸化物としてできるアルデヒドは、体に害がありますが、また、体もそれらを解毒・排泄する仕組みを持っています。
ビタミンEとビタミンCが不足していなければ、抗酸化作用によって過酸化脂質の増加を抑え、また、過酸化脂質はグルタチオンとグルタチオン抱合体となり、メルカプト酸 (メルカプツール酸)となって尿から排泄されます。
ところで、この記事とは関係ありませんが、油をとり過ぎると動脈硬化が進むという話を読みました。血が止まりにくくなる以外にも注意が必要かもしれません。

また、オメガ3全般については、オメガ3について知っておきたいことをお読み下さい。