極性についての覚え書きです。油を抽出する溶媒ヘキサンについての補足記事です。

| H 2.1 |
||||||
| Li 1.0 |
Be 1.5 |
B 2.0 |
C 2.5 |
N 3.0 |
O 3.5 |
F 4.0 |
| Na 0.9 |
Mg 1.2 |
Al 1.5 |
Si 1.8 |
P 2.1 |
S 2.5 |
Cl 3.0 |
| K 0.8 |
Ca 1.0 |
Ga 1.6 |
Ge 1.8 |
As 2.0 |
Se 2.4 |
Br 2.8 |
| Rb 0.8 |
Sr 1.0 |
In 1.7 |
Sn 1.8 |
Sb 1.9 |
Te 2.1 |
I 2.5 |
理解しやすい化学Ⅰ・Ⅱ (改訂版)にはこのように書かれていました。
電気陰性度
共有結合をつくっている原子が電子対を引きつける強さの尺度を電気陰性度という。表の元素記号の下にある数字が電気陰性度を表している数字です。
数字は、上の表を見てください。
極性とは
異なる元素の原子間の共有結合では、電気陰性度の大きい原子のほうに、共有結合対はかたよって存在する。
そのため、電気陰性度の大きい原子は、少しだけ負の電荷δ(デルタ)-を帯び、電気陰性度の小さい原子は、少しだけ正の電荷δ(デルタ)+を帯びる。
このように、結合に電荷のかたよりがあることを、結合に極性があるという。
これは図を見ていただいた方が早いでしょう。
共有結合とイオン結合
極性の強さは、結合した原子間の電気陰性度の差が大きいほど大きい。そして、電気陰性度の差が著しく大きい場合は、一方の原子に電子対が完全に移動するため、イオン結合を形成する。
一般に、ポーリングの電気陰性度の差が1.7以下の結合の多くは共有結合、電気陰性度の差が1.7以上の結合の多くはイオン結合として区別されるが、異種原子間の結合には、共有結合性とイオン結合性の両方が含まれている。
たとえば、塩化水素分子H-Clの場合、約83%が共有結合性で、約17%がイオン結合性の結合である。

その他に、参考になることも載せられていました。
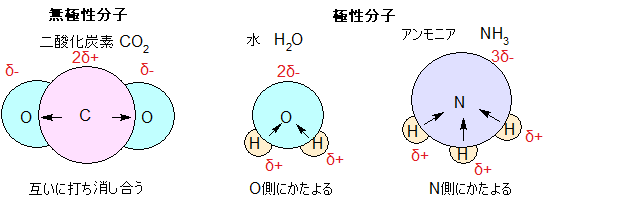
- 単体・・・無極性分子
- 異種二原子分子の化合物・・・極性分子
- 多原子分子の化合物+対称構造(直線形・正四面体形)・・・無極性分子
- 多原子分子の化合物+非対称構造(折れ線形・三角錐形)・・・極性分子
油を抽出する溶媒ヘキサンについてへ戻る。

油を抽出する溶媒ヘキサンについて
この記事では、大豆油などを抽出するときに使われる溶剤ヘキサンについて、構造や性質について説明し、実際に油を抽出するときの手順と、その後毒性をもつヘキサンをどのように取り除くかを調べて書きました。 ヘキサンはメタンやプロパン、ブタンの仲間 ヘ...